| intra-operatorio | transitoria esclusione polmonare |
| post-operatorio | definitiva riduzione del parenchima polmonare |
Alcuni studi da
praticare nel periodo pre-operatorio si prestano ad esprimere il giudizio
di operabilità. Essi sono: l'anamnesi, l'emogasnalisi, la spirometria
e la scintigrafia polmonare.
| Sindromi restrittive | sindromi restrittive
edema polmonare fibrosi polmonare insufficiente secrezione di surfactante |
| Sindromi ostruttive | COPD
asma broncostenosi stenosi vie aeree ab ingestis traumi |
| Affezioni della meccanica della parete | versamenti
emorragia pneumotorace |
| Aumento del lavoro della respirazione | gravidanza
ascite obesità |
| Difetti della parete | scoliosi
cifosi torace a ventola (flail chest) |
| Malattie muscolari con diminuzioni della forza | malnutrizione
miastenia paralisi |
Senza entrare nei dettagli si può affermare che la PO2 come test clinico è molto meno significativa rispetto alla PCO2. Questo particolare comportamento è giustificato dalla capacità di diffusione, attraverso la membrana respiratoria, della CO2 che è circa 20 volte maggiore rispetto alla diffusibilità dell'O2.
Il bilancio acido-base è il secondo parametro che emerge dall'emogasnalisi. La CO2 è scambiata continuamente attraverso l'apparato respiratorio, ma non è solo un gas in quanto possiede anche un impatto come buffer sull'equilibrio del pH che è regolato, a medio-lungo termine, dall'emuntorio renale.
Affinché
lo scambio gassoso tra aria atmosferica e i gas trasportati nel sangue
possa avvenire in modo continuativo e corretto deve essere garantita una
ventilazione ottimale mediante una successione di atti respiratori.
La figura mostra
i volumi, o capacità, e i relativi nomi. Si tratta di volumi importanti,
ma che prescindono dal tempo, mentre per una analisi più accurata
è importante anche valutare il tempo impiegato (spirometria
dinamica) a raggiungere un particolare volume e lo sforzo muscolare
necessario per provocarli. Uno sforzo sub-massimale può falsare
completamente l'esame e renderlo privo di significato.
In altre parole
al volume inspirato o espirato (VC
o capacità vitale) si aggiunge la misura del flusso istantaneo.
Una delle più sensibili è rappresentata dal volume espirato
in un secondo FEV1
(Forced Expiratory Volume /1 second). Altre misurazioni sono il FIV1
(Forced Inxpiratory Volume /1 second) e il FEF 25-75
cioè il flusso relativo alla porzione media dell'atto espiratorio
dal 25% al 75% (Forced Expiratory Flux 25-75
chiamato
anche MMEF 25-75%
Maximal Mid_Expiratory Flow) e il FEF 50
cioè il flusso istantaneo alla fine dell'espirazione del 50% della
capacità vitale (Forced Expiratory Flow 50).
| FEV1 | volume espirato in un secondo |
| FIV1 | volume inspirato in un secondo |
|
FEF
25-75
MMEF
25-75%
|
flusso relativo alla porzione media dell'atto espiratorio dal 25 al 75% (Forced Expiratory Flow - Maximal Mid_Expiratory Flow) |
| FEF 50 | flusso istantaneo alla fine dell'espirazione del 50% della capacità vitale (Forced Expiratory Flow) |
Nei casi con ostruzione della via aerea si può verificare un intrappolamento di aria e come conseguenza il volume totale di aria espirata (FVC o Forced Vital Capacity) può essere inferiore alla capacità vitale (VC) registrata durante l'inspirazione.
Il FEV50 viene determinato dalla curva flusso/volume o da quella volume/tempo.
I valori di riferimento per il FVC, FEV1, FEF25-75, FEF50 sono determinati in base all'età, al peso corporeo e al sesso seguendo le formule predittive di Morris del 1971 e Crapo del 1981.
Il FEV1 viene espresso anche come percentuale del FVC mentre non sono disponibili valori di riferimento per il FIV1 che è quasi uguale alla CV e che può quindi anche superare il FEV1.
Bisogna
tenere presente che le formule sono state determinate in modo empirico
su ampie casistiche di persone sane e con affezioni polmonari. Vengono
riportati alcuni valore di riferimento per sesso ed età.
| FEV1 | ||
| età | maschio | femmina |
| 20-39 | 3.11-4.64 | 2.16-3.65 |
| 40-59 | 2.45-3.98 | 1.60-3.09 |
| 60-70 | 2.09-3.32 | 1.30-2.53 |
| FEV1/Vital Capacity (FEV%) | ||
| età | maschio | femmina |
| 20-39 | 77 | 82 |
| 40-59 | 70 | 77 |
| 60-70 | 66 | 74 |
| MMEF 25-75% | ||
| età | maschio | femmina |
| 20-39 | 3.8 | 3.4 |
| 40-59 | 2.8 | 2.2 |
| 60-70 | 2.2 | 1.6 |
Le formule per ottenere i valori di riferimento sono quelle
sottoelencate:
| A | H | W | C | RSD | |
| Maschio | |||||
| TLC | +6.92 | -0.017 | -4.30 | 0.67 | |
| VC | -0.02 | +4.81 | -2.81 | 0.5 | |
| FRC | +0.015 | +5.3 | -0.037 | -3.89 | 0.56 |
| FRC/TLC% | +018 | -0.12 | +52.3 | 6.8 | |
| FEV1 | -0.033 | +3.44 | -1 | 0.5 | |
| FEV% | -0.37 | +91.8 | 7.2 | ||
| MMEF25-75% | -0.0523 | +5.85 | 1 | ||
| Femmina | |||||
| TLC | -0.015 | +6.71 | -5.77 | 0.48 | |
| VC | -0.022 | +4.04 | -2.35 | 0.4 | |
| FRC | +5.13 | -0.028 | -4.5 | 0.41 | |
| FRC/TLC% | +0.16 | -0.08 | +45.2 | 4.7 | |
| FEV1 | -0.028 | +2.67 | -0.54 | 0.36 | |
| FEV% | -0.26 | +92.1 | 5.4 | ||
| MMEF25-75% | -0.0579 | +5.63 | 0.71 | ||
| valore cercato= (A*età) + (H*altezza) + (W*peso) + C ± 2RSD | |
| A | Age, età approssimata all'anno più vicino |
| H | Height, altezza in metri |
| W | Weight, peso in Kg |
| C | Constant, costante |
| RSD | Residual Standard Deviation, deviazione standard residua |
| TLC | Total Lung Capacity |
| VC | Vital Capacity |
| FRC | Functional Residual Capacity |
| FRC/TLC% | Functional Residual Capacity/Total Lung Capacity % |
| FEV1 | Forced Expiratory Volume in 1 second |
| FEV% | FEV1 as percent of nonforced expiratory VC |
| MMEF25-75% | mean flow rate during the middle half of the forced expiratory vital capacity |
| tratta da: G. Birath, Acta Med Scand 173:193, 1963; G. Grimby, Acta Med Scand 173:199, 1963 | |
I tracciati anormali
sono classificati in due categorie principali: con deficit
di tipo ostruttivo e di tipo restrittivo.
Il tracciato del deficit di tipo restrittivo assomiglia a un tracciato normale, ma tutti i volumi appaiono proporzionalmente ridotti. Solitamente il rapporto FEV1/FVC è superiore al 70%, mentre le altre misurazioni appaiono diminuite specie se la VC è ridotta. In questi casi con VC ridotta il FEV1 può uguagliare la VC.
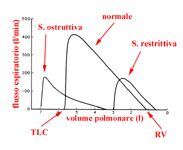 |
La morfologia
schematica di un tracciato dinamico normale e alterato da una affezione
restrittiva e da una ostruttiva.
RV
- Residual Volume
TLC
- Total Lung Capacity
|
Con il deficit
di tipo
ostruttivo FEV1
e FEF25-75 appariranno
ridotti e il rapporto FEV1/FVC
sarà inferiore al 70%. La FVC è ridotta anche a causa dell'aumento
del volume residuo. Le principali affezioni capaci di causare un deficit
ostruttivo sono le seguenti: asma, bronchite ed enfisema.
Nella pratica
corrente una buona base di partenza per analizzare un tracciato spirometrico
prende avvio dalla misurazione del FVC e del FEV1.
In questo modo si identificano due condizioni fondamentali:
| FVC | basso | normale o basso |
| FEV1/FVC | normale | basso |
| deficit di tipo | restrittivo | ostruttivo |
Il rapporto FEV1/FVC
si presta bene a identificare il deficit ostruttivo,
ma non deve essere utilizzato come parametro per stimarne la gravità
o la reazione alla terapia; per quantificare il deficit ostruttivo è
più utile il FEV1 da solo se paragonato in percentuale
al valore stimato con le formule. Solitamente vengono presi come soglia
il 50% e il 70%:
| deficit ostruttivo | |
| FEV1>70% | deficit leggero |
| 50%<FEV1<70% | deficit moderato |
| FEV1<50% | deficit grave |
L'ostruzione delle
via aeree può essere individuata confrontando FEV1 e FIV1:
| determinazione sede del deficit ostruttivo | ||
| FEV1 | diminuita | diminuita |
| FIV1 | normale | diminuita |
| FIV1>FEV1 | FIV1<FEV1 | |
| ostruzione piccole vie aeree (intraparenchimali) | ostruzione vie aeree superiori | |
Le cause principali
di ostruzione della via aerea superiore sono: le
stenosi tracheali, le affezioni della laringe.
Un approccio simile
a quanto fatto per il FEV1 può essere valido per la stima
del deficit restrittivo utilizzando la FVC
paragonata in percentuale al valore atteso con le formule.
in previsione di interventi demolitivi sul parenchima polmonare (segmentectomie, lobectomie e pneumonectomie)
Il quesito verte attorno a un unico punto: "il malato sarà in grado di sopportare l'esclusione polmonare temporanea intra-operatoria e nel periodo post-operatorio, dopo la perdita irreversibile di tessuto polmonare, sarà ancora in grado di ventilare in modo autonomo e adeguato?". Molti dei pazienti che vengono avviati a un intervento di chirurgia toracica sono affetti da una neoplasia polmonare e buona parte hanno inalato cronicamente polveri, gas o fumi che hanno danneggiato irreversibilmente il parenchima polmonare. Con queste premesse è verosimile che i pazienti possano presentare una broncopatia polmonare ostruttiva (COPD) con ipertensione polmonare e un cuore polmonare cronico.
| test atti a valutare l'operabilità in ordine logico di esecuzione | |||
| step | esame | soglia | note |
| 1 | PaCO2 | >45 mmHg | ventilazione compromessa |
| 2 | FEV1/FVC | <50% | limitazione dell'attività fisica, rischio chirurgico elevato |
| FEV1 | <2 l | ||
| 3 | FEV1post-op | >0.81 l | operabile |
| FEV1post-op% | >40 | ||
| FEV1post-op | <0.81 l | inoperabile | |
| FEV1post-op% | <30 | ||
| FEV1post-op% | 30<-<40 | border line | |
| 4 | DLCO | <30 | inoperabile |
| >35 | operabile | ||
La
valutazione
scintigrafica con TC99
consente di calcolare i paramentri ventilatori post intervento. Il razionale
parte
dalla valutazione della percentuale
di parenchima polmonare funzionante residuo (NL%), che viene determinato
con metodiche scintigrafiche, e si basa sulle seguenti formule:
| FEV1post-op = FEV1pre-op * NL% |
| FEV1post-op = (FEV1pre-op * NL%)/ FEV1normale |
| i pedici pre-op, post-op e normale si riferiscono al periodo preoparatorio, post-operatorio e ai valori normali calcolati con le formule viste nel paragrafo sulla spirometria. |
Bisogna considerare
che il polmone è composto da unità funzionali, i segmenti,
in numero totale di 42, così divisi:
| segmenti polmone destro | % | % | segmenti polmone sinistro | ||
| lobo superiore | 6 | 14 | 24 | 10 | lobo superiore |
| lobo medio | 4 | 9 | - | - | - |
| lobo inferiore | 12 | 29 | 24 | 10 | lobo inferiore |
| totale 42 segmenti | 22 | 52 | 48 | 20 | 100% organo |
I 42 segmenti possiedono la percentuale di parenchima indicata in tabella.
|
|
diventerà
|
|
cioè un
valore al limite dell'operabilità.
Il valore ottenuto
dal calcolo è superiore a quello indicato nella tabella con i valori
di riferimento, ma è necessario avere sempre
un margine di sicurezza in quanto durante il periodo post-operatorio
compaiono alcune situazioni anatomiche e funzionali che possono ridurre
pericolosamente questo valore teorico al di sotto del valore soglia. Le
principali condizioni che possono ridurre la soglia sono:
| lo staging intra-operatorio può invitare a resezioni maggiori di quanto preventivato; |
| la funzione polmonare residua può essere compromessa nel post-operatorio per l'insorgere di atelettasia, flogosi, edema polmonare, versamento pleurico; |
| la funzione del polmone controlaterale può peggiorare per motivi simili a quelli del punto precedente. Inoltre la condizione di compressione del mediastino sul polmone gravitario, che è provocata dal decubito laterale obbligato da mantenere durante l'intervento, è essa stessa una causa di alterata dinamica respiratoria. |
Per questo motivo
un margine di sicurezza ragionevole deve ammontare
ad almeno un 15-20%. La condizione preopratoria è condizionante
non solo per il risultato immediato, ma anche a distanza:
Oltre alla valutazione
della funzione ventilatoria bisogna considerare anche le modificazioni
della dinamica circolatoria. Nel soggetto normale e sano il letto vascolare
polmonare presenta una altissima compliance, cioè modificazioni
della portata anche molto elevate (nell'ordine del 250%) non provocano
significativi aumenti della pressione del circolo. Nel paziente candidato
a interventi resettivi sul parenchima polmonare è quasi sempre presente
qualche malattia polmonare concomitante (COPD) che nel lungo periodo può
essere stata causa di un quadro di ipertensione polmonare con cuore polmonare
cronico. Ne consegue che in questi malati la perdita di una porzione del
letto vascolare può essere causa di un aumento critico della pressione
polmonare con conseguente scompenso del circolo destro durante il periodo
intra- e post-operatorio. I principali segni radiologici di ipertensione
polmonare sono i seguenti:
| segni radiologici | dilatazione dei rami principali dell'arteria polmonare |
| attenuazione del disegno vascolare periferico e mantellare | |
| presenza di COPD con iperespansione polmonare, orizontalizzazione delle coste, aumento della dimensione degli spazi intercostali, abbassamento e appiattimento del diaframma | |
| riduzione dello spazio aereo retrosternale | |
| ipertrofia ventricolare destra con cuore piccolo in relazione alla cassa toracica |
A questi vanno
aggiunti i segni elettrocardiografici e auscultatori.
La preparazione all'intervento
Da quanto espresso
sopra, ne consegue che l'intervento debba essere pianificato con cura in
modo da eliminare tutte le cause che limitano la ventilazione e la perfusione
o addirittura in modo da migliorare la performance applicando i seguenti
presidi:
| interrompere il fumo almeno 6-10 settimane prima dell'intervento. Questa misura può essere fonte di un aumento della produzione delle secrezioni che vanno drenate col drenaggio posturale o rimosse mediante broncosopia; |
| fluidificazione delle secrezioni e bonifica di ogni fonte di infezione o flogosi cronica dei distretti tracheo-bronco-polmonari; |
| broncodilatazione con b-agonisti anche in assenza di un broncospasmo conclamato |
| miglioramento della meccanica respiratoria mediante esercizi fisici e mediante esercizi respiratori (spirometria incentivante) |
| miglioramento della meccanica respiratoria mediante riparazione dei difetti della parete toracica e addominale (ernia, laparocele, etc.) |
| O2 terapia |
| miglioramento dello stato nutrizionale e terapia delle affezioni concomitanti |
Quando
un soggetto sano è in ortostatismo,
e respira con entrambi i polmoni, per ragioni di forza di gravità
la perfusione è diretta quasi completamente verso le porzioni basali
dei polmoni. Anche la ventilazione subisce, per motivi analoghi, una distribuzione
secondo un gradiente apico-basale imposto dalla forza di gravità.
In un grafico pressione/volume, che dimostra la compliance polmonare, le
zone
basali del polmone lavorano sulla porzione
ripida della curva, mentre le zone apicali
lavorano sulla parte più alta e quasi piatta.
Quando
la ventilazione e la perfusione sono bilanciate come avviene nel soggetto
sano, e quindi gli scambi sono ottimali, il rapporto
V/Q è uguale a circa 0.8.
La
dinamica varia completamente quando il paziente giace in
clinostasi e in aggiunta presenta un decubito laterale obbligato come avviene
in chirurgia toracica. In questa situazione i due polmoni vengono
ventilati e perfusi secondo il gradiente visto sopra, ma disposto in senso
latero-laterale (invece che cranio-caudale). In questa situazione il
rapporto V/Q rimane ottimale in quanto il riarrangiamento della
distribuzione dei flussi aereo e sanguigno è ben bilanciata con
un aumento nella zona declive sia della ventilazione sia della perfusione.
La
situazione si modifica radicalmente quando il malato viene sottoposto
ad anestesia ventilando entrambi i polmoni (ventilazione bipolmonare);
la prima conseguenza è la riduzione della
capacità funzionale residua (FRC,
functional residual capacity). Questa riduzione sposta la curva di lavoro
dei polmoni verso il basso e a sinistra per cui il polmone
inferiore (gravitario) è costretto a lavorare sulla parte piatta,
mentre il polmone superiore (antigravitario) è
forzato a lavorare sulla parte ripida e lineare. Ne consegue che
il rapporto V/Q viene modificato: il polmone gravitario
(inferiore) subisce un eccesso di perfusione
(V<Q) rispetto alla ventilazione con un effetto simile allo
shunt
mentre il polmone antigravitario (superiore)
subisce un eccesso di ventilazione rispetto
alla perfusione con un effetto simile all'aumento
dello spazio morto (V>Q).
Riassumendo:
| ortostasi | gradiente apico-basale | V/Q = 0.8 | |
| clinostasi su di un fianco | gradiente latero-laterale | V/Q conservato | |
| decubito laterale in anestesia torace chiuso | gradiente latero-laterale | V/Q alterato | shunt polmone gravitario e aumento spazio morto polmone antigravitario |
| decubito laterale in anestesia torace aperto | gradiente latero-laterale | V/Q alterato | shunt polmone gravitario e aumento spazio morto polmone antigravitario |
| modificazioni del rapporto V/Q durante l'anestesia a torace chiuso | ||
| polmone gravitario (inferiore) | eccesso di perfusione rispetto alla ventilazione | shunt |
| polmone antigravitario (superiore) | eccesso di ventilazione rispetto alla perfusione | aumento dello spazio morto |
Ad aggravare la
situazione si aggiungono la ventilazione intermittente a pressione positiva,
la paralisi della muscolatura e l'apertura della parete toracica che provocano:
| modificazioni del rapporto V/Q durante l'anestesia con miorilassamento e a torace aperto | |
| causa | effetto |
| la tendenza allo spostamento del mediastino verso il basso | compressione del polmone gravitario con riduzione del FRC |
| la tendenza allo spostamento dei visceri addominali verso l'alto | compressione del polmone gravitario con riduzione del FRC |
| diversione marcata della ventilazione verso il polmone antigravitario | ulteriore squilibrio del rapporto V/Q |
Come risultato
finale si ottiene che il polmone inferiore o gravitario subisce un aumento
ulteriore della perfusione, mentre quello superiore, o antigravitario,
subisce un aumento ulteriore della ventilazione. L'effetto è quello
di aumentare l'effetto shunt (V<Q) e l'effetto di spazio morto (V>Q).
La situazione cambia ancora quando il malato, sottoposto ad anestesia, passa dalla respirazione bipolmonare a quella monopolmonare. Il polmone escluso completamente dalla ventilazione è sede di uno shunt (V/Q=0) che stravolge gli scambi gassosi con una riduzione della ossigenazione ematica mentre lo smaltimento della CO2 rimane invariato. I seguenti fattori intervengono a compensare questa situazione, che alla lunga potrebbe essere insostenibile:
| il polmone soggetto a intervento è di solito affetto da malattia e presenta già di base una alterazione del rapporto V/Q (solitamente Q ridotto); |
| il chirurgo provvede a interrompere i vasi e quindi lo shunt. |
Per queste ragioni
è importante non alterare con interventi farmacologici gli effetti
della HPV. Possono essere causa di alterazione dell'HPV in particolare:
| causa | effetto |
| iper- e ipo-tensione polmonare | riduzione della HPV |
| iper- e ipo-capnia | riduzione della HPV |
| valori alti o bassi della PvO2 | riduzione della HPV |
| gittata cardiaca | inversamente proporzionale alla HPV |
| vasodilatatori (Ca-antagonisti, b2-agonisti, dobutamina, nitroglicerina, nitroprussiato, etc.) | riduzione modesta della HPV |
| vasocostrittori (dopamina, adrenalina, etc.) | riduzione della HPV |
| PEEP | riduzione della HPV |
| riduzione della FIO2 (come i vasocostrittori) | riduzione della HPV |
| l'isofluorano, propofol (molti farmaci alterano la HPV in modo indiretto e non chiaro) | nessun effetto sulla HPV |